Malsovaĝigitaj antaŭ 6 000–10 000 jaroj en la montaro de Andoj de suda Peruo [1, 2], la kultivita terpomon (Solanum tuberosum L.) rapide fariĝis unu el la plej gravaj bazaj alimentoj en ĉiuj landoj [3]. Kun tutmonda produktado de 377 milionoj da tunoj en 2016, por tuta malneta valoro de 11 miliardoj da dolaroj, terpomoj nun estas la kvara plej grava manĝaĵo en la mondo, post rizo, tritiko kaj maizo [4].
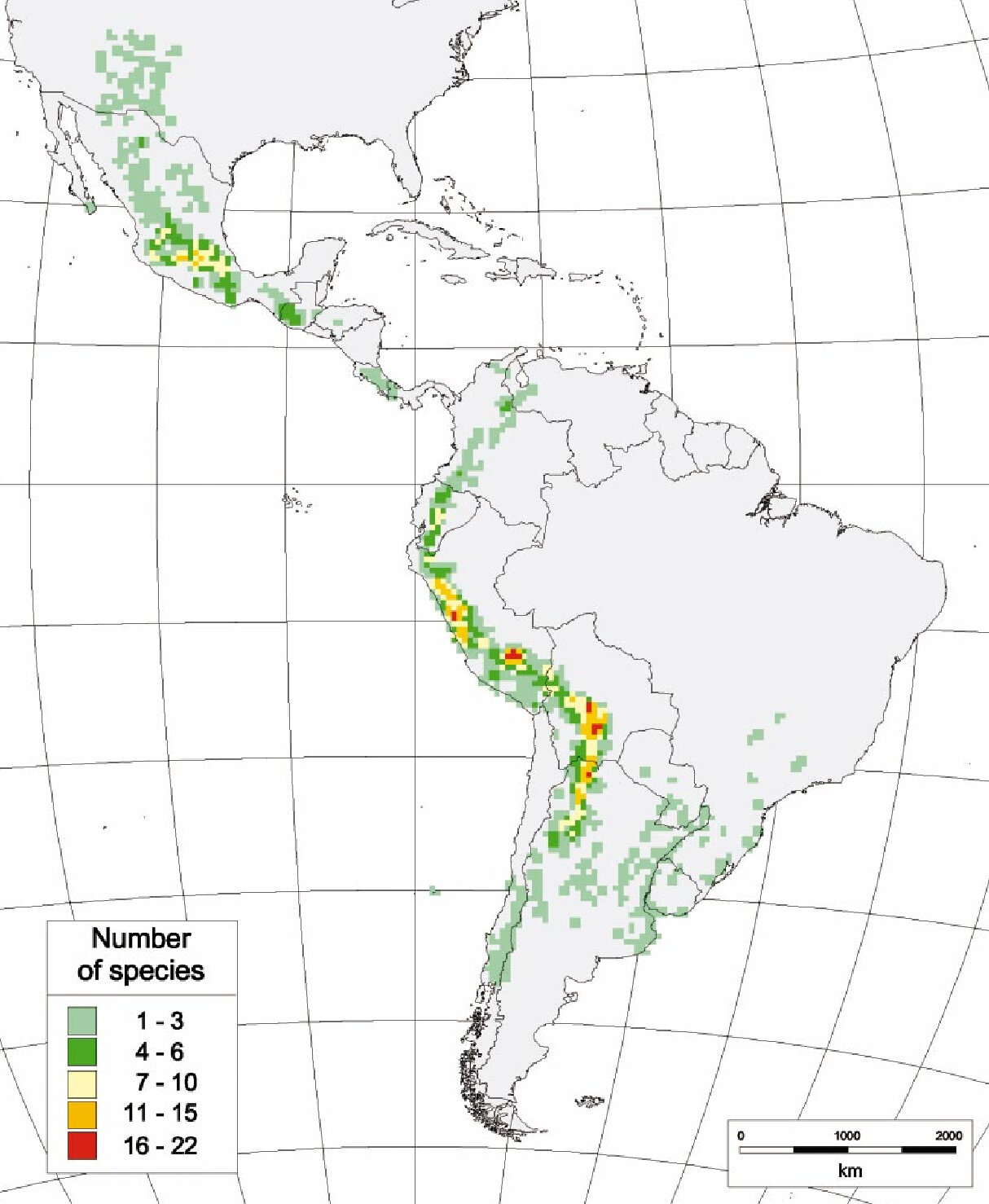
La aktualaj direktoj por bredado de terpomoj celas plibonigi rendimentojn, kongruecon kun la bezonoj de la agrikultura industrio, reziston al abiotaj streĉiĝoj (ekz. sekeco) kaj reziston al patogenoj [5, 6]. En ilia serĉado pri interesaj trajtoj por S. tuberosum, bredantoj povas utiligi la grandan botanikon diversecon de terpomoj, kiuj inkludas 4 kultivitajn speciojn kaj 107 sovaĝajn speciojn [2], distribuitaj tra Latin-Ameriko (Figuro 1), de Nov-Meksiko ĝis Patagonio [7, 8].
Adaptitaj al ampleksa aro de mediaj kaj klimataj kondiĉoj, sovaĝaj terpomoj havas dezirindajn karakterizaĵojn por agrikulturo, kiel ekzemple pli grandan reziston al patogenoj kaj sekeco. Pluraj tutgenaraj studoj faritaj lastatempe en la terpoma klado (Solanum sect. Petota) efektive malkaŝis la eksterordinaran genetikan diversecon de sovaĝaj specioj kaj ĝian utilecon por la bredado de terpomoj [9, 10].
S. chacoense: resurso por terpoma bredado…
Mia esplorprojekto temas pri la reprodukta biologio de la sovaĝa specio de terpomo Solanum chacoense (Figuro 2), kies genaro ĵus estis sekvencita [11]. S. chacoense interesita la agrikultura esploro pro ĝia alta rezisto al larĝa gamo de terpomaj patogenoj, kiel la terpomviruso Y [12, 13], la bakterioj kiuj kaŭzas terpoman putradon [14, 15] kaj komunan skabon [16, 17], aŭ la fungoj respondecaj pri nigra skvamo, nigra gambo [18], kaj melduo [19].
Solanum chacoense ankaŭ havas specialan sekundaran metabolon, kiu produktas grandajn kvantojn de apartaj glukalkaloidaj komponaĵoj, kiel ekzemple leptinoj kaj leptininoj [20], kiuj estas ege efikaj kontraŭ la terpoma skarabo [21]. Tiu malgranda herbivora insekto (Figuro 3) estas danĝera plagoj, kiu povas tute detrui terpomajn kulturojn per nutrado de folioj. Aktuale, sciencoprojektoj celas pli bone kompreni genojn implikitajn en tiuj metabolaj vojoj [22, 23] kaj enkonduki ilin en la kultivitan terpomon [24, 25, 26, 27].
…kaj modelo por studi seksan reprodukton
Estante duploida specio, S. chacoense ankaŭ estas studita kiel alternativa modelo al la kvarploida kultivita terpomo por molekula kaj ĉela biologio, precipe por esplorado pri planta seksa reprodukto. Ekzemple, en nia esplorinstituto, S. chacoense estis uzita en la laboratorio Cappadocia por deĉifri la mekanismojn regantajn gametofita mem-neagordigebleco en la Solanacoj [28, 29, 30, 31]. La laboratorio Geitmann, nun bazita en la McGill University, ankaŭ uzis S. chacoense en ĝia esplorado pri citomekaniko de la kreskado de polentuboj [32, 33, 34].
La laboratorio Matton malkovris plurajn proteinojn implikitajn en reproduktaj signalaj kaskadoj en S. chacoense, kiel RALF-peptidoj [35, 36], MAP-kinazoj [37, 38, 39, 40] kaj kinaz-receptoroj [41, 42, 43, 44]. Nia laboratorio ankaŭ produktis grandskale transkriptomikajn [45], proteomikajn [46] kaj sekretomikajn [47] studojn por pli bone kompreni la reprodukton de S. chacoense.
Mia doktora projekto celas kompreni kiel la interagoj inter poleno kaj pistilo, precipe la atrakcio de polen-tuboj, estas implikitaj en la reprodukta izolado de sovaĝaj terpomoj, tio estas, la mekanismoj per kiuj ili evitas interspecifan hibridiĝon.


Referencoj
- Spooner DM, McLean K, Ramsay G, Waugh R and Bryan GJ. (2005). A single domestication for potato based on multilocus amplified fragment length polymorphism genotyping. Proc. Natl. Acad. Sci. U. S. A., 102(41): 14694–9. DOI: 10.1073/pnas.0507400102
- Spooner DM, Ghislain M, Simon R, Jansky SH and Gavrilenko T. (2014). Systematics, diversity, genetics, and evolution of wild and cultivated potatoes. Bot. Rev., 80(4): 283–383. DOI: 10.1007/s12229-014-9146-y
- Birch PRJ, Bryan G, Fenton B, Gilroy EM, Hein I, Jones JT, … Toth IK. (2012). Crops that feed the world 8: Potato: are the trends of increased global production sustainable? Food Sec., 4(4): 477–508. DOI: 10.1007/s12571-012-0220-1
- Food and of the United Nations AO. (2016). FAO Statistics Division data for year 2016. URL: http://www.fao.org/faostat/en (accessed August 1, 2018).
- Halterman D, Guenthner J, Collinge S, Butler N and Douches D. (2015). Biotech potatoes in the 21st century: 20 years since the first biotech potato. Am. J. Potato Res., 93(1): 1–20. DOI: 10.1007/s12230-015-9485-1
- Hameed A, Zaidi SS-E-A, Shakir S and Mansoor S. (2018). Applications of new breeding technologies for potato improvement. Front. Plant Sci., 9: 925. DOI: 10.3389/fpls.2018.00925
- Hijmans RJ and Spooner DM. (2001). Geographic distribution of wild potato species. Am. J. Bot., 88(11): 2101–12.
- Hijmans RJ, Spooner DM, Salas AR, Guarino L and de la Cruz J. (2002). Atlas of wild potatoes. Rome, Italy: International Plant Genetic Resources Institute.
- Hardigan MA, Laimbeer FPE, Newton L, Crisovan E, Hamilton JP, Vaillancourt B, … Buell CR. (2017). Genome diversity of tuber-bearing Solanum uncovers complex evolutionary history and targets of domestication in the cultivated potato. Proc. Natl. Acad. Sci. U. S. A. DOI: 10.1073/pnas.1714380114
- Li Y, Colleoni C, Zhang J, Liang Q, Hu Y, Ruess H, … Huang B. (2018). Genomic analyses yield markers for identifying agronomically important genes in potato. Mol. Plant, 11(3): 473–84. DOI: 10.1016/j.molp.2018.01.009
- Leisner CP, Hamilton JP, Crisovan E, Manrique-Carpintero NC, Marand AP, Newton L, … Buell CR. (2018). Genome sequence of M6, a diploid inbred clone of the high-glycoalkaloid-producing tuber-bearing potato species Solanum chacoense, reveals residual heterozygosity. Plant J., 94(3): 562–70. DOI: 10.1111/tpj.13857
- Bravo-Almonacid F, Rudoy V, Welin B, Segretin ME, Bedogni MC, Stolowicz F, … Mentaberry A. (2012). Field testing, gene flow assessment and pre-commercial studies on transgenic Solanum tuberosum spp. tuberosum (cv. Spunta) selected for PVY resistance in Argentina. Transgenic Res., 21(5): 967–82. DOI: 10.1007/s11248-011-9584-9
- Duan H, Richael C and Rommens CM. (2012). Overexpression of the wild potato eIF4E-1 variant Eva1 elicits Potato virus Y resistance in plants silenced for native eIF4E-1. Transgenic Res., 21(5): 929–38. DOI: 10.1007/s11248-011-9576-9
- Bae J, Halterman D and Jansky S. (2008). Development of a molecular marker associated with Verticillium wilt resistance in diploid interspecific potato hybrids. Mol. Breed., 22(1): 61–9. DOI: 10.1007/s11032-008-9156-8
- Chen L, Guo X, Xie C, He L, Cai X, Tian L, … Liu J. (2013). Nuclear and cytoplasmic genome components of Solanum tuberosum + S. chacoense somatic hybrids and three SSR alleles related to bacterial wilt resistance. Theor. Appl. Genet., 126(7): 1861–72. DOI: 10.1007/s00122-013-2098-5
- Braun SR, Endelman JB, Haynes KG and Jansky SH. (2017). Quantitative trait loci for resistance to common scab and cold-induced sweetening in diploid potato. Plant Genome, 10(3). DOI: 10.3835/plantgenome2016.10.0110
- Jansky S, Douches D and Haynes K. (2017). Transmission of scab resistance to tetraploid potato via unilateral sexual polyploidization. Am. J. Potato Res., 95(3): 272–7. DOI: 10.1007/s12230-017-9628-7
- Almasia NI, Bazzini AA, Hopp HE and Vazquez-Rovere C. (2008). Overexpression of snakin-1 gene enhances resistance to Rhizoctonia solani and Erwinia carotovora in transgenic potato plants. Mol. Plant Pathol., 9(3): 329–38. DOI: 10.1111/j.1364-3703.2008.00469.x
- Faccio P, Vazquez-Rovere C, Hopp E, González G, Décima-Oneto C, Favret E, … Franzone P. (2011). Increased tolerance to wheat powdery mildew by heterologous constitutive expression of the Solanum chacoense. Czech J. Genet. Plant Breed., 47(Special issue): S135–41.
- Mweetwa AM, Hunter D, Poe R, Harich KC, Ginzberg I, Veilleux RE and Tokuhisa JG. (2012). Steroidal glycoalkaloids in Solanum chacoense. Phytochemistry, 75: 32–40. DOI: 10.1016/j.phytochem.2011.12.003
- Lorenzen JH, Balbyshev NF, Lafta AM, Casper H, Tian X and Sagredo B. (2001). Resistant potato selections contain leptine and inhibit development of the Colorado potato beetle (Coleoptera: Chrysomelidae). J. Econ. Entomol., 94(5): 1260–7.
- Manrique-Carpintero NC, Tokuhisa JG, Ginzberg I, Holliday JA and Veilleux RE. (2013). Sequence diversity in coding regions of candidate genes in the glycoalkaloid biosynthetic pathway of wild potato species. G3: Genes, Genomes, Genet., 3(9): 1467–79. DOI: 10.1534/g3.113.007146
- Manrique-Carpintero NC, Tokuhisa JG, Ginzberg I and Veilleux RE. (2014). Allelic variation in genes contributing to glycoalkaloid biosynthesis in a diploid interspecific population of potato. Theor. Appl. Genet., 127(2): 391–405. DOI: 10.1007/s00122-013-2226-2
- Cooper SG, Douches DS and Grafius EJ. (2009). Combining engineered resistance, avidin, and natural resistance derived from Solanum chacoense bitter to control Colorado potato beetle (Coleoptera: Chrysomelidae). J. Econ. Entomol., 102(3): 1270–80.
- Ginzberg I, Thippeswamy M, Fogelman E, Demirel U, Mweetwa AM, Tokuhisa J and Veilleux RE. (2012). Induction of potato steroidal glycoalkaloid biosynthetic pathway by overexpression of cDNA encoding primary metabolism HMG-CoA reductase and squalene synthase. Planta, 235(6): 1341–53. DOI: 10.1007/s00425-011-1578-6
- Molnár I, Besenyei E, Thieme R, Thieme T, Aurori A, Baricz A, … Rakosy-Tican E. (2017). Mismatch repair deficiency increases the transfer of antibiosis and antixenosis properties against Colorado potato beetle in somatic hybrids of Solanum tuberosum + S. chacoense. Pest Manag. Sci., 73(7): 1428–37. DOI: 10.1002/ps.4473
- Crossley MS, Schoville SD, Haagenson DM and Jansky SH. (2018). Plant resistance to Colorado potato beetle (Coleoptera: Chrysomelidae) in diploid F2 families derived from crosses between cultivated and wild potato. J. Econ. Entomol. DOI: 10.1093/jee/toy120
- Boivin N, Morse D and Cappadocia M. (2014). Degradation of S-RNase in compatible pollen tubes of Solanum chacoense inferred by immunogold labeling. J. Cell Sci., 127(Pt 19): 4123–7. DOI: 10.1242/jcs.154823
- Soulard J, Boivin N, Morse D and Cappadocia M. (2014). eEF1A is an S-RNase binding factor in self-incompatible Solanum chacoense. PLoS One, 9(2): e90206. DOI: 10.1371/journal.pone.0090206
- Soulard J, Qin X, Boivin N, Morse D and Cappadocia M. (2013). A new dual-specific incompatibility allele revealed by absence of glycosylation in the conserved C2 site of a Solanum chacoense S-RNase. J. Exp. Bot., 64(7): 1995–2003. DOI: 10.1093/jxb/ert059
- Liu B, Boivin N, Morse D and Cappadocia M. (2012). A time course of GFP expression and mRNA stability in pollen tubes following compatible and incompatible pollinations in Solanum chacoense. Sex. Plant Reprod., 25(3): 205–13. DOI: 10.1007/s00497-012-0192-5
- Aouar L, Chebli Y and Geitmann A. (2010). Morphogenesis of complex plant cell shapes: the mechanical role of crystalline cellulose in growing pollen tubes. Sex. Plant Reprod., 23(1): 15–27. DOI: 10.1007/s00497-009-0110-7
- Parre E and Geitmann A. (2005). Pectin and the role of the physical properties of the cell wall in pollen tube growth of Solanum chacoense. Planta, 220(4): 582–92. DOI: 10.1007/s00425-004-1368-5
- Parre E and Geitmann A. (2005). More than a leak sealant. The mechanical properties of callose in pollen tubes. Plant Physiol., 137(1): 274–86. DOI: 10.1104/pp.104.050773
- Chevalier E, Loubert-Hudon A and Matton DP. (2013). ScRALF3, a secreted RALF-like peptide involved in cell-cell communication between the sporophyte and the female gametophyte in a solanaceous species. Plant J., 73(6): 1019–33. DOI: 10.1111/tpj.12096
- Germain H, Chevalier E, Caron S and Matton DP. (2005). Characterization of five RALF-like genes from Solanum chacoense provides support for a developmental role in plants. Planta, 220(3): 447–54. DOI: 10.1007/s00425-004-1352-0
- Daigle C and Matton DP. (2015). Genome-wide analysis of MAPKKKs shows expansion and evolution of a new MEKK class involved in solanaceous species sexual reproduction. BMC Genomics, 16: 1037. DOI: 10.1186/s12864-015-2228-3
- Lafleur E, Kapfer C, Joly V, Liu Y, Tebbji F, Daigle C, … Matton DP. (2015). The FRK1 mitogen-activated protein kinase kinase kinase (MAPKKK) from Solanum chacoense is involved in embryo sac and pollen development. J. Exp. Bot., 66(7): 1833–43. DOI: 10.1093/jxb/eru524
- O’Brien M, Gray-Mitsumune M, Kapfer C, Bertrand C and Matton DP. (2007). The ScFRK2 MAP kinase kinase kinase from Solanum chacoense affects pollen development and viability. Planta, 225(5): 1221–31. DOI: 10.1007/s00425-006-0432-8
- Gray-Mitsumune M, O’Brien M, Bertrand C, Tebbji F, Nantel A and Matton DP. (2006). Loss of ovule identity induced by overexpression of the fertilization-related kinase 2 (ScFRK2), a MAPKKK from Solanum chacoense. J. Exp. Bot., 57(15): 4171–87. DOI: 10.1093/jxb/erl194
- Germain H, Gray-Mitsumune M, Houde J, Benhamman R, Sawasaki T, Endo Y and Matton DP. (2013). The Solanum chacoense ovary receptor kinase 11 (ScORK11) undergoes tissue-dependent transcriptional, translational and post-translational regulation. Plant Physiol. Biochem., 70: 261–8. DOI: 10.1016/j.plaphy.2013.05.036
- Germain H, Gray-Mitsumune M, Lafleur E and Matton DP. (2008). ScORK17, a transmembrane receptor-like kinase predominantly expressed in ovules is involved in seed development. Planta, 228(5): 851–62. DOI: 10.1007/s00425-008-0787-0
- Germain H, Houde J, Gray-Mitsumune M, Sawasaki T, Endo Y, Rivoal J and Matton DP. (2007). Characterization of ScORK28, a transmembrane functional protein receptor kinase predominantly expressed in ovaries from the wild potato species Solanum chacoense. FEBS Lett., 581(26): 5137–42. DOI: 10.1016/j.febslet.2007.10.001
- Germain H, Rudd S, Zotti C, Caron S, O’Brien M, Chantha S-C, … Matton DP. (2005). A 6374 unigene set corresponding to low abundance transcripts expressed following fertilization in Solanum chacoense Bitt, and characterization of 30 receptor-like kinases. Plant Mol. Biol., 59(3): 515–32. DOI: 10.1007/s11103-005-0536-8
- Tebbji F, Nantel A and Matton DP. (2010). Transcription profiling of fertilization and early seed development events in a solanaceous species using a 7.7 K cDNA microarray from Solanum chacoense ovules. BMC Plant Biol., 10: 174. DOI: 10.1186/1471-2229-10-174
- Vyetrogon K, Tebbji F, Olson DJH, Ross ARS and Matton DP. (2007). A comparative proteome and phosphoproteome analysis of differentially regulated proteins during fertilization in the self-incompatible species Solanum chacoense Bitt. Proteomics, 7(2): 232–47. DOI: 10.1002/pmic.200600399
- Liu Y, Joly V, Dorion S, Rivoal J and Matton DP. (2015). The plant ovule secretome: a different view toward pollen–pistil interactions. J. Proteome Res., 14(11): 4763–75. DOI: 10.1021/acs.jproteome.5b00618